12個境外已上市臨床急需腫瘤新藥分析!
加入日期:2018/9/15 14:07:18 查看人數: 1429 作者:admin
為加快境外已上市臨床急需新藥進入我國,國家藥品監督管理局、國家衛生與健康委員會組織有關專家對近年來美國、歐盟或日本批準上市新藥進行了梳理,遴選出了Alectinib Hydrochloride等48個境外已上市臨床急需新藥名單。
該名單重點考慮近年來美國、歐盟或日本批準上市我國尚未上市的用于罕見病治療的新藥,以及用于防治嚴重危及生命或嚴重影響生活質量的疾病,且尚無有效治療手段或具有明顯臨床優勢的新藥。
根據相關規定,納入境外已上市臨床急需新藥名單的藥品,尚未進行申報的或正在我國開展臨床試驗的,經申請人研究認為不存在人種差異的,均可提交或補交境外取得的全部研究資料和不存在人種差異的支持性材料,直接提出上市申請,國家藥品監督管理局將按照優先審評審批程序,加快審評審批。這意味著48個產品若進入《境外已上市臨床急需新藥名單》正式稿有可能在國內獲得加快審評。
腫瘤作為最熱的治療領域,在該名單中也占比最大,腫瘤藥共12個產品進入名單,占25%。咸達藥海遨游數據對這12個產品的國內申報情況與未來趨勢進行分析點評。
國內已上市類
1 Alectinib Hydrochloride(阿來替尼)
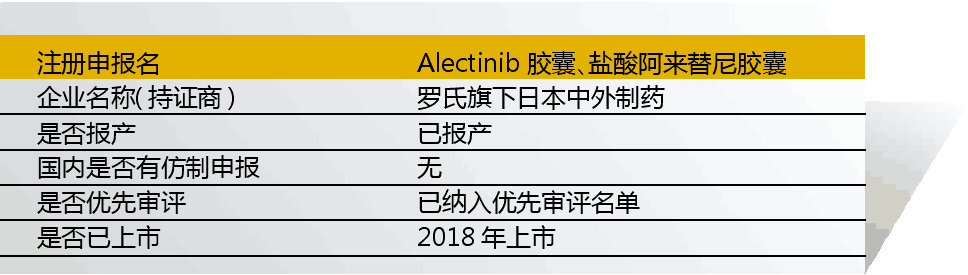
阿來替尼由羅氏/Excella聯合開發,入選“境外已上市臨床急需新藥名單”的適應癥為“間變性淋巴瘤激酶(ALK)陽性非小細胞肺癌、非小細胞肺癌”。入選理由是“第三代ALK激酶抑制劑,對現有治療克唑替尼耐藥患者仍有效,與克唑替尼比較的研究顯示本品可顯著延長無進展生存時間(25.7vs10.4),有突出優勢”。
其已納入優先審評名單,理由是與現有治療手段相比具有明顯治療優勢。2018年8月,該品種150mg上市,商品名為安圣莎,注冊證號為H20180047。
2015年、2016年,該藥在國內啟動阿來替尼的臨床試驗CTR20150592、CTR20160367,與克唑替尼比較治療ALK陽性晚期非小細胞肺癌的療效。
點評
實際上,鹽酸阿來替尼膠囊無需進入此名單就已獲批上市。非小細胞肺癌是腫瘤中最熱的適應癥,預計原研藥上市后,仿制藥也會跟進。
2 Pembrolizumab(帕博利珠單抗)

帕博利珠單抗為默沙東研制產品,入選“境外已上市臨床急需新藥名單”的適應癥為“晚期黑色素瘤、轉移性黑色素瘤、非小細胞肺癌、頭頸癌、黑色素瘤”。入選理由是“美國首個批準的PD-1抑制劑,在多個腫瘤中均顯示了療效,尤其在非小細胞肺癌一、二線治療均證實了長期生存獲益”。
其已納入優先審評名單,理由也是與現有治療手段相比具有明顯治療優勢。2018年7月,該品種100mg/4ml獲批上市,商品名為可瑞達(美國商品名為KEYTRUDA),注冊證號為S20180019。
2016年起,默沙東已在國內開展對晚期或轉移性黑色素瘤、晚期胃腺癌、晚期食管癌、晚期肝細胞癌、轉移性鱗狀非小細胞肺癌治療的臨床試驗。
點評
2018年7月帕博利珠單抗注射液在國內是以黑色素瘤適應癥獲批上市的,進入“境外已上市臨床急需新藥名單”后,非小細胞肺癌適應癥有望加快獲批。
18 Palbociclib(哌柏西利)
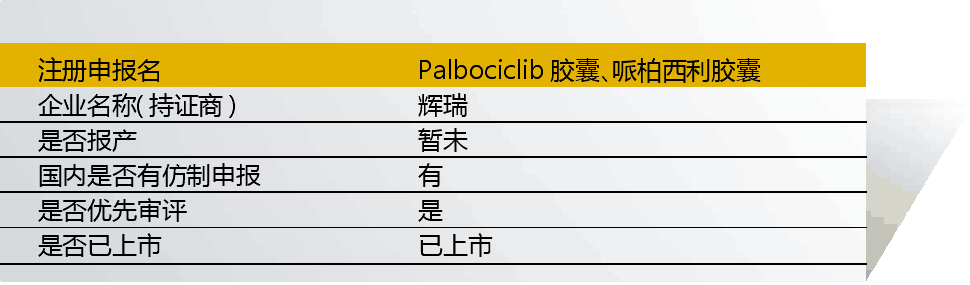
哌柏西利由輝瑞研制,入選“境外已上市臨床急需新藥名單”的適應癥為“乳腺癌”。入選理由是“全球首個上市的CDK4、6抑制劑,在全球臨床試驗中顯示出了突出的臨床獲益”。
2014年起,該藥在國內開展ER(+)、HER2(-)女性絕經后晚期乳腺癌臨床試驗。
該藥以與現有治療手段相比具有明顯治療優勢為由獲得優先審評。目前已上市3個規格,125mg(H20180040)、75mg(H20180041)、100mg(H20180042)。
國內藥企仿制申報活躍,包括康美、南京海納、正大天晴、浙江海正、江蘇恒瑞、江蘇萬邦、瑞陽制藥/北京陽光諾和、山東羅欣、江蘇奧賽康和齊魯制藥等。
點評
本產品僅申報臨床就已獲批上市。作為指南一線用藥,市場潛力大,仿制藥競爭也會非常激烈。
上市提速類
3 Olaparib(奧拉帕尼)

奧拉帕尼由阿斯利康和艾伯維聯合開發,入選“境外已上市臨床急需新藥名單”的適應癥為“晚期卵巢癌、原發性腹膜癌、輸卵管癌、上皮性卵巢癌、BRCA突變的晚期卵巢癌”。入選理由是“卵巢癌為常見婦科腫瘤,晚期疾病以化療為主。Olaparib為全球首個開發的PARP抑制劑,Ⅲ期研究顯示,相對安慰劑組,Olaparib可明顯延長無進展生存(19.1vs5.5)。基于突出的臨床優勢,國外批準用于復發的鉑敏感復發性卵巢上皮癌的維持治療,目前中國尚無藥物批準用于該人群,存在明確臨床需求”。
2014年起,該藥已在國內開展對晚期胃癌、BRCA突變的晚期卵巢癌、gBRCA1/2突變且高危HER2陰性完成輔助(新輔助)治療的早期原發性乳腺癌、實體瘤的臨床試驗。
目前奧拉帕尼尚未在國內上市。但國內藥企仿制藥申報活躍,包括正大天晴、瑞陽制藥/北京陽光諾和、南京華威、北京康立生、四川科倫、江蘇豪森、山東羅欣等。
點評
原研藥有望加快獲批上市。暫無仿制藥開始BE研究,但已有不少仿制藥完成藥學研究。原研藥上市后,預計仿制藥也會積極加快啟動BE研究。
11 Denosumab(狄諾塞單抗)
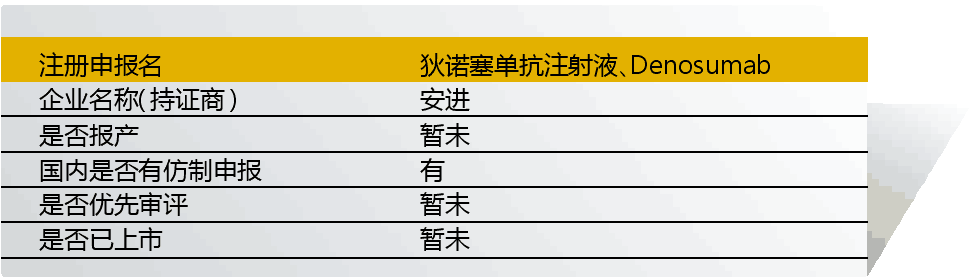
狄諾塞單抗由安進與葛蘭素史克聯合開發,入選“境外已上市臨床急需新藥名單”的適應癥為“骨轉移性實體瘤、骨癌、實體瘤、巨骨細胞瘤、多發性骨髓瘤、高鈣血癥、類風濕性關節炎、骨質疏松癥”。入選理由是“骨巨細胞瘤發病率低,3/100萬,好發于青壯年,對手術切除可能導致嚴重功能障礙的患者以及不可切除的中軸骨病變患者確無有效的治療手段,Denosumab國外研究顯示達到70%以上的腫瘤緩解率”。
2013年起,該藥已在國內啟動骨質疏松、預防實體瘤骨轉移患者發生骨相關事件的臨床試驗。
目前狄諾塞單抗尚未在國內上市。但國內仿制方面,菲洋生物科技(吉林)/蘇州康寧杰瑞生物已開展臨床研究。
點評
原研藥有望加快上市申報,且暫未開展臨床試驗的適應癥都有望獲批。
14 Ponatinib(泊那替尼)
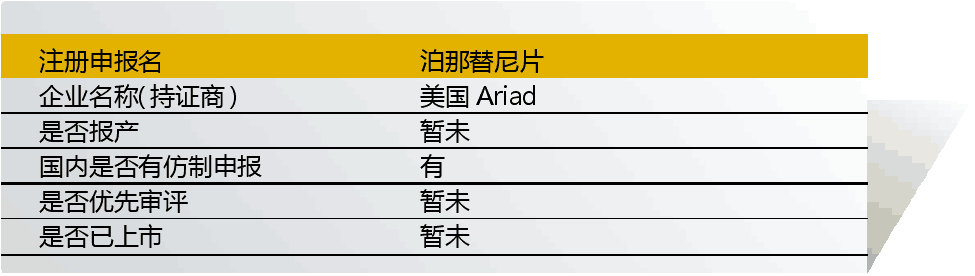
泊那替尼由日本大冢制藥與美國Ariad聯合開發,入選“境外已上市臨床急需新藥名單”的適應癥為“慢性髓細胞性白血病、急性淋巴細胞白血病、白血病”。入選理由是“Ponatinib 為第三代Bcr-Abl激酶靶向抑制劑,對T315I突變型Bcr-Abl激酶具有高效特異性抑制作用,可有效解決現有以伊馬替尼為代表的靶向抑制Bcr-Abl激酶的CML治療藥物普遍存在的、因激酶突變引起耐藥性的缺陷”。
該藥目前尚未在國內上市,也未在國內開展臨床試驗。國內仿制方面,僅杭州德潤玉成生物申報了原料藥(普維替尼)。
點評
雖在國內尚未啟動臨床試驗,但原研藥有望直接申報上市并加快獲批。2016年該藥在日本獲批,帶有紅色警告標簽。
20 Enasidenib mesylate

Enasidenib mesylate由新基研制,入選“境外已上市臨床急需新藥名單”的適應癥為“急性骨髓性白血病”。入選理由是“Enasidenib 是全球首個批準的針對IDH2突變的成人AML患者的藥物,IDH2突變在AML中大約占17%。對于復發難治的AML目前尚無標準的有效治療,國外研究顯示本品在具有IDH2突變的復發難治的AML中獲得23%的完全緩解率和8.2個月的緩解持續時間”。
目前該藥暫未國內上市。2017年,該藥在國內啟動針對急性髓系白血病(CTR20170961)的臨床試驗。
點評
原研藥有望加快上市申報。
罕見病類
入選“境外已上市臨床急需新藥名單”的腫瘤藥中,有5個品種屬于罕見病類別,包括Vismodegib、Dinutuximab、Sonidegib、Olaratumab、Dinutuximab Beta。這5個品種都是未啟動國內申報、未啟動國內臨床、未上市的品種。
此外,除了基因泰克研制的Vismodegib目前有國內仿制申報(包括南京華威、北京依諾泰/長沙手性、正大天晴)之外,其余4個產品都未有國內仿制申報。
23 Vismodegib

點評
該品種原研藥暫未開展國內申報。對于罕見病,仿制藥是否也可以擁有加快審評的優待,仍待政策的進一步落實。
33 Dinutuximab

34 Sonidegib

35 Olaratumab

38 Dinutuximab Beta

點評
罕見病市場非常小。以上4種新藥國內暫無原研藥和仿制藥申報,如果入選目錄,尚不了解會否有企業采取進口代理方式引進國內。
結語<<<
8月20日《國務院辦公廳關于印發深化醫藥衛生體制改革2018年下半年重點工作任務的通知》發布,國家醫保局、國家衛生健康委、國家藥監局負責有序加快境外已上市新藥在境內上市審批。這意味著類似的目錄未來會越來越多,臨床必需的境外產品上市也會越來越多。
對入選“境外已上市臨床急需新藥名單”的腫瘤藥進行分析可以發現,有些產品此前因優先審評已獲批上市,個別產品將受益于未獲批的適應癥。部分產品國內臨床未完成或未開展,也有望通過此政策在國內實現快速上升。
 主站蜘蛛池模板:
射洪县|
三门县|
临泉县|
固安县|
蕉岭县|
安泽县|
阳江市|
平武县|
大连市|
随州市|
象山县|
丹阳市|
靖边县|
青神县|
鹤庆县|
潮州市|
镇安县|
白河县|
栾城县|
正宁县|
连城县|
饶阳县|
牙克石市|
维西|
福安市|
赣榆县|
馆陶县|
古蔺县|
彭泽县|
永吉县|
吉木萨尔县|
焦作市|
鹰潭市|
峨山|
河池市|
新巴尔虎右旗|
保山市|
钟祥市|
贵州省|
遵义县|
鹤庆县|
主站蜘蛛池模板:
射洪县|
三门县|
临泉县|
固安县|
蕉岭县|
安泽县|
阳江市|
平武县|
大连市|
随州市|
象山县|
丹阳市|
靖边县|
青神县|
鹤庆县|
潮州市|
镇安县|
白河县|
栾城县|
正宁县|
连城县|
饶阳县|
牙克石市|
维西|
福安市|
赣榆县|
馆陶县|
古蔺县|
彭泽县|
永吉县|
吉木萨尔县|
焦作市|
鹰潭市|
峨山|
河池市|
新巴尔虎右旗|
保山市|
钟祥市|
贵州省|
遵义县|
鹤庆县|